Paramètres physiques et chimiques des eaux et commentaires*
(m a j 15.6.2022)
Ce qui suit n’est pas un cours de chimie de l’eau, mais seulement une présentation sommaire des nombreux paramètres physicochimiques plus ou moins usuels des eaux et des substances qui peuvent s’y retrouver.
L’estimation de la qualité physique et chimique d’une eau ne peut s’effectuer pas la mesure d’un seul, mais d’un ensemble de paramètres de nature diverses.

Des résultats anormaux dans le contrôle de paramètres permettent de déceler et d’évaluer les niveaux de pollutions.
La pollution de l’eau est fonction des substances dissoutes susceptibles d’être nuisibles qu’elle contient et, dont la plupart, ne sont décelables qu’à l’analyse.
NB: Certains sels minéraux d’origine naturelle (calcium, sodium, silice,..) présents dans les eaux mais peu concernés ne sont pas abordés ici.
Si certaines substances ont la faculté de se dissoudre dans l’eau c’est que leurs molécules, à l’image des aimants, recèlent une certaine polarité. Leurs pôles et ceux des molécules d’eau s’attirent.
A l’inverse, les substances aux molécules sans polarité (apolaires) sont peu solubles. Déversées dans les eaux, elles flottent à la surface ou descendent plus ou moins lentement vers le fond selon leur densité pour s’y déposer. Pour ces dernières, c’est principalement l’action physique du courant de l’eau qui les remet en suspension.
ANALYSER L’EAU c’est d’abord une affaire de spécialistes compétents pour réaliser suivant les buts recherché les mesures d’un éventail de paramètres physicochimiques représentatifs réalisées selon des conditions, méthodes et normes officielles. Un grand nombre d’analyses officielles concernant l’eau peuvent être retrouvés en ligne sur internet sur les sites publics concernant par la surveillance des eaux superficielles, des eaux souterraines et de l’eau du robinet.
Cependant sur le terrain des amateurs motivés ou des protecteurs de l’environnement sont parfois amener à réaliser certaines mesures sommaires dites analyses de terrain ne demandant pas des moyens complexes dans des buts d’investigations concernant certaines pollutions ou tout simplement de meilleure connaissance de l’état et du fonctionnement d’un milieu aquatique. Les résultats de ces tests au bord de l’eau doivent cependant être regardés avec une grande prudence par des non chimistes d’autant que certains paramètres peuvent varier les uns par rapport à d’autres ou provoquer des interférences.
(Par exemple, plus la température de l’eau est basse, plus sa charge en oxygène dissous peut être élevée).
On peut se référer aux valeurs des paramètres physico-chimiques généraux figurant en page 75 du Guide 2019 relatif à l’évaluation de l’état des eaux de surface auquel on se reportera pour connaitre les paramètres et données recherchées. ( Cette page 75 directement accessible ici ).
Pour les eaux souterraines on pourra se référer au tableau extrait de l’arrêté du 25/01/2010 modifié.
PARAMÈTRES PHYSIQUES (usuels)
TURBIDITÉ (Transparence)
C’est un paramètre, qui varie en fonction des composés colloïdaux (argiles, débris de roche, micro-organismes,…) ou aux acides humiques (dégradation des végétaux) mais aussi pollutions qui troublent l’eau . Avec un appareil (turbidimètre) on mesure la résistance qu’elle oppose par l’eau au passage de la lumière pour lui donner une valeur..
En France on mesure la turbidité par la méthode normalisée NTU (Nephelometric Turbidity Unit) par spectrométrie, c’est à dire mesure de l’absorption de la lumière par l’eau.
– NTU < 5 => eau claire
– NTU < 30 => eau légèrement trouble
– NTU > 50 => Eau trouble.
Une importante turbidité de l’eau entraine une réduction de sa transparence qui réduit la pénétration du rayonnement solaire utile à la vie aquatique (photosynthèse).

La turbidité de l’eau peut aussi être mesurée en cm par une autre méthode beaucoup plus simple avec un disque de Secchi. (prononcez séki) C’est un disque de 20cm de diamètres lesté qui est descendu horizontalement au bout d’une cordelette (qui peut être graduée en cm) dans l’eau d’un lac, d’une rivière, d’un bassin de station d’épuration. Les quatre quarts du disque sont noirs et blancs pour que celui-ci soit bien visible. La longueur de cordelette entre la surface de l’eau et le niveau ou la profondeur ou le disque de Secchi devient invisible (On ne distingue plus les zones blanches des noires) donne la mesure arrondi au 10cm proche, par exemple 1,8 (pour 1,78m).
M E S
On appelle matières en suspension les très fines particules en suspension (sable, argile, produits organiques, particules de produits polluant, micro-organismes,…) qui donnent un aspect trouble à l’eau, (turbidité) est s’opposent à la pénétration de la lumière nécessaire à la vie aquatique.
En trop grande quantité elles constituent donc une pollution solide des eaux.
La quantité de matières en suspension totale (MEST) se mesure par filtration d’un litre d’eau et pesage des résidus séchés. Le résultat s’exprime en mg/l. (On estime qu’un habitant rejette environ 90 grammes par jour de MES dans ses eaux usées).

Les matières décantables : Leur mesure donne la quantité de solides non dissous présents dans l’eau.
Pendant 30 minutes on laisse un échantillon d’eau au repos déposer dans un cône d’Imhoff.
Ceci permet de mesurer la quantité de sédiments en mg par litre.
TEMPÉRATURE
La température de l’eau influe sur beaucoup d’autres paramètres.
C’est en premier lieu le cas pour l’oxygène dissous (dioxygène) indispensable à la vie aquatique en premier lieu à la respiration des poissons. En effet plus la température de l’eau d’un cour d’eau s’élève, plus sa quantité maximum d’oxygène dissous diminue.
Une température trop élevée des eaux d’une rivière peut donc aboutir à des situations dramatiques de manque d’oxygène dissous pouvant entraîner : la disparition de certaines espèces, la réduction de l’auto épuration, l’accumulation de dépôts nauséabonds (odeurs), la croissance accélérée des végétaux (dont les algues).
Les poissons ne peuvent survivre à des températures trop élevées. (Mortalité totale : truites de rivières à 27°C, truites arc en ciel à 29°C, brochets à 28°C, perches et tanches à 30°C, gardons à 31°C, carpes à 38°C).
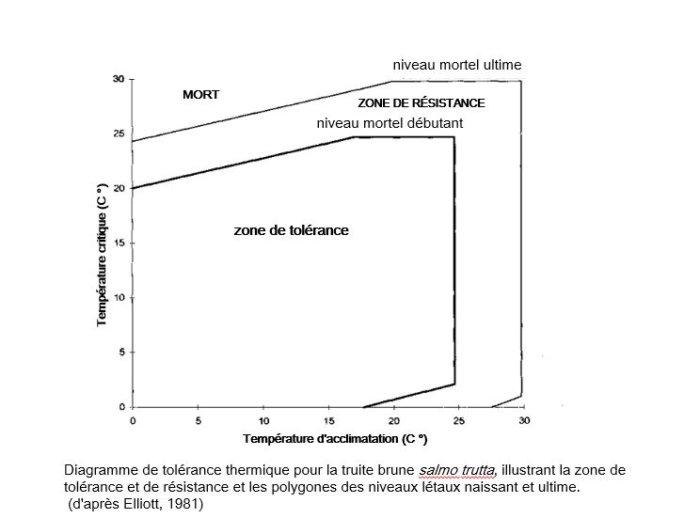
Le seuil de 25°C correspond à une mortalité létale de 50% des truites (acclimatées à une eau à 20°C suite à un échauffement brutal de 5°C). ( Les paramètres de la qualité des eaux, Brémond R., Perrodon C, Min. de l’env., 1979 ; p. 21). A partir de 19°C la survie des truites commence à être menacée.
La température idéale pour les truites (preferendum thermique) voisine autour de 15°C (dans une plage idéale sans perturbation entre 7 à 17°C.
La pollution thermique peut avoir pour origine des rejets d’eaux chaudes urbains ou industriels dans le cours d’eau. Dans les petits cours d’eau, elle peut avoir aussi pour origine les déversoirs d’étangs installés sur leur rive et qui par leur grande surface jouent un rôle de « pompe à chaleur »
En période estivale, par forte température atmosphérique, le réchauffement brutal par le soleil des eaux en mauvais état d’une rivière peu oxygénée peut aboutir à un choc thermique entraînant une mortalité piscicole spectaculaire. Les bordures boisées des cours d’eau (ripisylves) limitent l’échauffement des eaux, d’où un intérêt supplémentaire de les conserver.
La température de l’eau dans l’environnement se mesure en général avec un appareil multiparamètres (T, pH, conductivité) dont il suffit de plonger l’extrémité.
-> On consultera utilement plus bas dans cette page le paramètre: « OXYGÈNE DISSOUS »
*
A savoir:
En raison des variations de certains paramètres de l’eau avec la température (oxygène dissous, conductivité, …) les analyses normalisées sont effectuées sur des échantillons d’eau à 20° C. Pour les analyses de terrain, il faut donc tenir compte de la température de l’eau, et faire ensuite la conversion (tables). Certains appareils de mesure de terrain font automatiquement cette conversion en fonction de la température de l’eau.
Une thèse à consulter sur ce sujet : « Synthèse des tolérances thermiques des principales espèces de poissons des rivières et fleuves de plaine de l’ouest européen, L. Tissot, Y. Souchon, 2011 » : https://hal.archives-ouvertes.fr/hal-00602627/document
CONDUCTIVITÉ
La mesure en µS/cm ou mS/cm (micro ou milli Siemens par cm) de la conductivité électrique d’une eau s’effectue à l’aide d’un conductimètre. Celui-ci mesure le passage de l’électricité entre deux électrodes séparées par un cube de 1cm x 1cm d’eau. La mesure s’effectuer à 25° C ou avec un conductimètre avec compensateur automatique de température.
La conductivité d’une eau est l’inverse de sa résistivité électrique en µohm/cm ou mohm/cm (micro ou milli ohm/cm par cm).
Si l’eau très pure est un isolant qui oppose une grande résistance au passage de l’électricité, il n’en est plus de même lorsqu’elle est chargée en sels minéraux d’origine naturelle (calcium, magnésium, sodium, potassium). A cette minéralisation naturelle liée à la nature des sols s’ajoutent aussi …les polluants.
La conductivité permet d’apprécier globalement l’ensemble des produits en solution dans l’eau.
La mesure de la conductivité est un moyen assez simple de détection d’une anomalie indiquant la présence probable d’une pollution, par comparaison de la valeur mesurée avec celle que l’on était en droit d’attendre (par exemple la conductivité locale moyenne d’un cours d’eau). Elle peut permettre de localiser un apport de pollution.
Une charge importante de pollution organique augmente la conductivité.
Échelle indicative de conductivités naturelles de différentes eaux
– 60 à 100 µS/cm : Eau de pluie,
– 50 à 300 µS/cm : Eaux peu minéralisées (sols schisteux, volcaniques, granitiques)
– 550 µS/cm environ : Eau du robinet à Besançon (région calcaire),
– 300 à 700 µS/cm Eaux minéralisées (sols calcaires, marneux)
– 700 à 1200 µS/cm Eaux fortement minéralisées (sols gypseux, eaux salées)
*
Un conductimètre est l’appareil de base de toute personne qui s’intéresse à la qualité des cours d’eau et aux rejets polluants.
La conductivité de l’eau dans l’environnement se mesure en général avec un appareil multiparamètres (T, pH, conductivité) dont il suffit de plonger l’extrémité.
(prix environ 160 € en 2023 pour un conductimètre de poche Hanna HI 98312 ).
Les MVS
Ce paramètre est parfois utilisé. Les matières volatiles en suspension sont celles qui sont susceptibles d’être volatilisées par test de laboratoire à une température de 550° C. Les MVS sont généralement assimilées aux matières organiques en suspension. Les MVS se mesurent en mg/l.
PARAMÈTRES CHIMIQUES
Le pH
Ce paramètre, qui se mesure sur le terrain avec des bandelettes test ou un appareil (pH-mètre), donne le degré d’acidité ou d’alcalinité d’une eau. Le pH (potentiel hydrogène), est le reflet de la concentration d’une eau en ions H+ : ( pH = – log [H+] ).
L’eau des cours d’eaux avoisine en général la neutralité représentée par un pH de 7. (>7 milieu acide; <7 milieu alcalin)
Le pH doit être compris entre 6 et 8 pour permettre la vie aquatique.
Dans chaque milieu naturel les eaux ont une valeur de pH propre en fonction du sous-sol de leur bassin versant :
> 7 en régions calcaires où les eaux sont basiques car fortement minéralisées,
< 7 en région de sous-sol primaire (Vosges, ..) ou eaux sont acides.
(Exemple de valeur: eau du robinet à Besançon, pH 7,70 )
Une mesure de pH, différente de la valeur habituelle du cours d’eau, peut être l’indice d’une arrivée de pollution , en générale industrielle, en amont du point de mesure.
Sa valeur, le plus souvent mesurée à l’aide d’un pHmètre ou de « papier pH », indique si l’eau est acide (de 1 à <7), neutre ( 7 ), ou basique (de > 7 à 14); On dit aussi alcaline.
Le pH varie légèrement selon la température. L’analyse doit donc s’effectuer à 25° C ou avec un pHmètre avec compensateur automatique de température.
La conductivité de l’eau dans l’environnement se mesure en général avec un appareil multiparamètres (T, pH, conductivité) dont il suffit de plonger l’extrémité. (prix environ 150€)
DURETÉ
Une eau est dite douce ou dure selon sa charge en calcium et en magnésium.
La somme des deux éléments constitue le Titre Hydrotimétrique qui s’exprime en France en degrés français (symbole °f ou °fH) sur une échelle de 0 à 40.
(1°f = 4mg/l de calcium ou 2,4mg/l de magnésium).
– Une eau sera dite dure si son TH est > à 15 °f.
Une eau trop dure a pour inconvénients d’entartrer les canalisations et un usage plus important de détergents pour le lavage.
– Une eau sera dite douce si son TH est < à 15 °f.
Une eau trop douce sera dite «agressive » parce que corrosive pour les conduites.
L’OXYGÈNE DISSOUS ( O2 )
La présence d’oxygène dans l’eau est indispensable à la respiration des êtres vivants aérobies aquatiques. En dessous d’un certain seuil de concentration en oxygène c’est l’asphyxie des poissons. ( 7 mg/l pour les salmonidés; 3 mg/l pour les carpes)
L’oxygène de l’eau permet également le processus d’oxydation des matières organiques (autoépuration), mais cette décomposition appauvrit le milieu aquatique en oxygène.
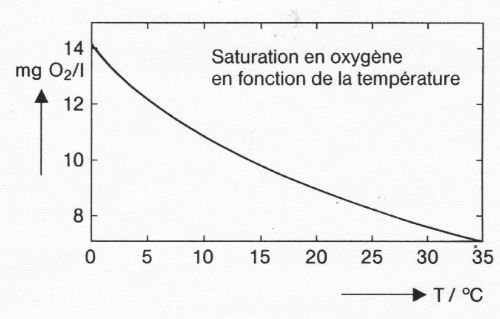
L’oxygénation de l’eau des cours d’eau provient d’abord du contact de sa surface avec l’atmosphère. Elle est favorisée par les remous, les turbulences, les chutes et surtout par une basse température de l’eau. Car plus l’eau s’échauffe, moins l’oxygène y est soluble. La pression atmosphérique influe aussi modestement. Valeurs de saturation en oxygène de l’eau en conditions ordinaires (pression atmosphérique 760 mm de Hg) :à 5°C, maximum d’oxygène dissous: 12,3mg/l.; à 10°C: 10,9 mg/l.; à 15°C: 9,7mg/l.; à 20°C: 8,8mg/l.; à 25°C : 8,1 mg/l.
Déficit en oxygène dissous . C’est le cas, lorsque la concentration en oxygène dissous mesurée est inférieure à la valeur de saturation. Ce peut être le cas par exemple, la nuit en été puisque les végétaux consomment de l’oxygène, et s’il y a trop de végétaux dans peu d’eau (sécheresse) ; la faune aquatique peut être alors être menacée d’asphyxie (anoxie) surtout en fin de nuit lorsque son déficit en O2 atteint son maximum.
En dessous de 6 mg/l. la faune aquatique est en danger, en premier lieux les salmonidés.
Sursaturation en oxygène dissous. Il y a sursaturation quand une oxygénation supplémentaire est apportée, par exemple le jour par beaucoup de plantes vertes aquatiques qui produisent de l’oxygène à la lumière du soleil.
La teneur en oxygène des eaux d’une rivière peut donc varier en cours de journée de plusieurs mg/l suivant la température et la présence ou non de végétaux aquatiques (jusqu’aux environs de 20mg/l en cas d’eutrophisation).
La teneur en oxygène des eaux d’une rivière varie aussi selon la profondeur: elle peut être très faible en eau profonde alors qu’elle peut approcher le taux de saturation près de la surface.
Le rôle d’une chute d’eau dans le bilan d’oxygène dissous d’une rivière
Une chute d’eau n’ajoute de l’oxygène à l’eau d’une rivière que s’il y a déséquilibre entre la concentration d’oxygène dissous dans l’eau et l’oxygène atmosphérique, ce qui peut être le cas en présence d’une charge des eaux en matière organique et minérale importante.
La chute d’eau d’un barrage ne permet de récupérer qu’une partie de l’oxygène dissous perdu par la rivière transformée en plan d’eau.
Pour mesurer l’oxygène dissous d’un cours d’eau
Il est possible d’utiliser un oxymètre électrochimique, matériel disposant d’une sonde spéciale à plonger dans l’eau.
Il existe aussi des trousses colorimétriques de terrain utilisant des réactifs chimiques (méthode de Winkler).
C’est un paramètre très important pour la vie dans la rivière (respiration des poissons).
– A à 15°C un litre d’eau peut avoir saturation en oxygène maximum de 9,7mg/l. de O2
– A 25°C, un litre d’eau peut concentrer jusqu’à 8,25 mg/l. de O2 et à 29°C , 7,5 mg/l. de O2.
-> On consultera utilement plus haut dans cette page l’exposé sur le paramètre « TEMPÉRATURE »
POTENTIEL REDOX ou potentiel d’oxydo-réduction (ORP)
Le potentiel d’oxydoréduction (ORP) est une mesure électronique empirique en volts (et notée Eh) réalisée à l’aide d’un appareil spécifique pour exprimer la réactivité entre eux des éléments et substances chimiques, soit oxydants, soit réducteurs, présents dans l’eau. En rivière ou plan d’eau de bonne qualité l’ORP doit s’élever de 300 et 500 mV. Une faible valeur d’ORP témoigne d’une insuffisance de décomposition d’éléments présents dans l’eau et de leur accumulation nocive à la vie aquatique.
RH2 C’est une autre approche plus précise en mesure électronique de l’évaluation de la forces des éléments oxydants et des réducteurs. Le RH2 est calculé à l’aide du pH et du potentiel rédox (E) Pour en savoir plus sur deux méthodes.
Présence de CHLORURE de calcium (sel).
Sa présence est peu nocive dans les eaux, mais dans un écoulement dans la Nature ,elle constitue un important indicateur d’arrivée d’effluents urbains . Le sel n’est pas éliminé par les stations d’épuration. Dans la Nature, la concentration naturelle de l’eau en chlorure est fonction de la géologie des sols et en générale inférieure à 50 mg/l.
Dans l’eau du robinet le maximum admis est de 250 mg/l. de chlorures.
MATIÈRES ORGANIQUES
La MATIÈRE ORGANIQUE (MO) contenue dans les eaux est la partie non encore décomposée de la pollution organique (matières vivantes mortes ou déjections de organismes vivants).
Elles sont donc naturellement présentes dans l’eau, mais à faible concentration. S’il y en à plus, il y a pollution provenant de rejets d’eaux usées domestiques mal épurés, d’effluents agricoles, etc.
La MO peut se rencontrer dans l’eau soit dissoute, soit sous forme particulaire visible.
La présence de dépôts de matière organique visibles dans le lit d’une rivière est inacceptable et dénonce bien souvent la proximité d’un rejet brut ou un très mauvais état de la rivière. (De plus la dégradation de la MO consomme et réduit l’oxygène dissoute de l’eau nécessaire à la vie aquatique).
La charge de pollution organique est quantifiable par des techniques normalisées : mesure de la DCO, mesure de la DBO5.
La MO constituée en grande partie d’AZOTE ORGANIQUE est en final décomposée par les bactéries principalement en AMMONIUM, puis en NITRITES et enfin en NITRATES.
Pour commentaires plus complets de ces 3 paramètres (évoqués que brièvement un peu plus bas,
-> Consulter la page consacrée au : CYCLE DE L’AZOTE
Pour quantifier les matières organiques présentes dans l’eau (il s’agit de pollution s’il y a excès), il n’y a pas de mesures directes mais des méthodes pour quantifier par des techniques normalisées l’oxygène nécessaire à leur décomposition:
– Méthode de la DBO5
( Demande Biologique en Oxygène )
La DBO5 est un indicateur de la pollution globale très utilisé pour le suivi de la qualité des eaux des rivières ou des effluents et rejets des stations d’épuration.
Cette technique permet de mesurer en laboratoire sur 5 jours (à 20° dans l’obscurité), la quantité d’oxygène consommée par le processus naturel de décomposition de la matière organique décomposable présente dans un litre d’eau. Le résultat est donné en mg/L. de ( O2 )
La DBO5 ou Demande Biologique en Oxygène sur 5 jours, représente la quantité d’oxygène nécessaire aux micro-organismes pour oxyder (dégrader) l’ensemble de la matière organique biodégradable présente dans un échantillon d’eau maintenu à 20°C, à l’obscurité, pendant 5 jours.
Plus la DBO5 est élevée, plus la quantité de matières organiques présentes dans l’eau est importante et plus la qualité de l’eau est mauvaise.
Mais la DBO5 ne quantifie que la pollution biodégradable. Pour le terrain on lui préfèrera donc la DCO (voir plus bas) qui concerne à la fois la pollution biodégradables et non biodégradable.
[Pour mesurer la DBO5, on réalise une première mesure de la concentration en dioxygène dans l’échantillon d’eau. On répète cette mesure 5 jours plus tard. La DBO5 représente la différence entre les deux concentrations mesurées].
La mesure de la DBO5 est un paramètre prescrit pour la surveillance des rejets et de fonctionnement des stations d’épuration (cf. : arrêté du 21 juillet 2015 relatif aux systèmes d’assainissement… ) mais elle est peu précise pour qualifier seule le bon état d’une eau naturelle.
La DBO5 d’une eau de surface non polluée, varie normalement de 2 à 20 mg/l. Au-delà, on peut suspecter une pollution nocive à la qualité de l’eau et la vie aquatique.
A noter que la DBO5 exprimée en kg/j. dans certains textes administratifs permet de désigner des quantités de pollution organique rejetées que l’on peut aussi estimer en EH (équivalents habitants) :
Un habitant produit en moyenne une charge de pollution équivalente à 60 grammes de DBO5 pour une journée. La directive européenne du 21 mai 1991 et l’ article R2224-6 du code général des collectivités territoriale définissent d’ailleurs l’équivalent-habitant (EH) comme la charge organique biodégradable ayant une demande biochimique d’oxygène en cinq jours (DBO5) de 60 grammes d’oxygène par jour.
. 1,2 kg de DBO5/j. (c-à-d rejetée par jour) correspond à une pollution de 20 EH
. 12 kg de DBO5/j. correspond à une pollution de 200 EH,
. 120 kg de DBO5/j. correspondant à la pollution de 2000 EH,
. 600 kg de DBO5/j. correspondant à la pollution de 10000 EH,
– Méthode de la DCO
( Demande Chimique en Oxygène)
La DCO est un autre indicateur de la pollution globale utilisé pour le suivi de la qualité des eaux des rivières ou des effluents.
Contrairement à la DBO5, qui ne prend en compte que les matières organiques biodégradables, la DCO est une mesure globale de toutes les matières organiques et de certains sels minéraux oxydables (pollution organique totale) présents dans l’eau. La DCO est donc plus représentative que la DBO car elle concerne l’ensemble de la pollution qu’elle soit biodégradable et non-biodégradable.
Cette technique mesure en laboratoire la quantité d’oxygène consommée par l’oxydation chimique (à l’aide d’un oxydant et à chaud, pendant 2 heures) des matières organiques ou minérales présentes dans l’eau.
Il existe des systèmes permettant d’effectuer des analyses sommaires rapides de la DCO d’un échantillon d’eau (environ 2 heures). Le résultat est donné en mg/L. de ( O2 ).
Définition : La demande chimique en oxygène (DCO) est la quantité consommée par les matières oxydantes présentes dans l’eau quelles que soit leur origine organique ou minérale.
La mesure de la DCO est surtout utilisée pour la surveillance des eaux usées urbaines et industrielles.
Le rapport DCO / DBO5 donne une indication sur l’origine de la pollution organique. Ainsi exemples de valeurs :
– une eau résiduaire brute: 2500 / 1000 = 2,5
– une eau épurée : 450 : 40 = 11
Plus il se rapproche de 1, plus le rapport DCO / DBO5, indique la biodégradabilité d’un rejet d’eaux usées:
– de 1,5 à 2 : effluents d’industries agroalimentaires (meilleure biodégradabilité).
– de 2 à 3 : effluent urbain domestique.
– >3 : effluent plus ou moins difficilement biodégradable (industrie).
Le rapport DCO / DBO5 permet aussi d’estimer la biodégradabilité d’un effluent :
- < 2 : effluent facilement biodégradable
- entre 2 et 4 : effluent moyennement biodégradable
- > 4 : effluent difficilement biodégradable
.
Pour quantifier la matière organique dans l’eau on peut aussi à l’aide d’analyses mesurer :
Le COT c’est-à-dire la concentration en mg/l. de carbone organique total dissous dans l’eau. On parle aussi parfois de COD, carbone organique dissous.
Pour une eau de surface, La concentration du COT d’une eau de surface varie de 2 à 10 mg/l et de 0,5 à 1 mg/l. pour une eau souterraine.
(Contrairement aux analyses précises de DBO5, les mesures de COD n’exigent pas des réactifs contenant du mercure, pour masquer le chlorure présent dans les eaux).
AMMONIUM (NH_4) et AMMONIAC (NH3)
L’azote ammoniacal est souvent le principal indicateur chimique de pollution directe d’une eau de rivière à l’aval d’un rejet polluant (plus encore en aval elle se transforme en nitrites puis en nitrates). C’est en détectant la présence d’ammonium que l’on peut situer le long d’un cours d’eau les arrivées d’eaux usées car les déjections humaines et animales sont sources d’ammoniac. Naturellement dans les eaux la présence d’ammoniac ne dépasse pas 0,1mg/L.
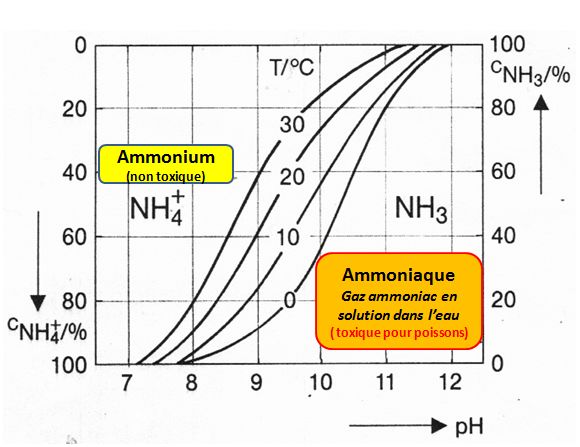
Dans l’eau, en fonction du pH et de la température, l’azote ammoniacal se rencontre sous deux formes AMMONIUM et AMMONIAQUE :
(On utilise souvent à tort le terme « ammoniaque » pour ces deux formes. C’est un produit industriel contenant de l’ammoniac dissous dans de l’eau).
L’azote ammoniacal provient de la décomposition des chaînes carbonées constituant les matières organique par les bactéries de type aérobies majoritairement (bacillus, bacterium). Cette dégradation consomme de l’oxygène et libère également du CO2 dans les eaux.
. L’azote ammoniacal provient aussi de l’urée rejetée par les animaux. (Par exemple, une pollution au purin entraîne une présence élevée d’ammonium dans l’eau polluée).
On peut trouver des traces d’ammoniaque dans les eaux de pluie. Elles sont liées aux retombées liées à sa volatilisation (par exemple lors d’épandage agricoles)
La forme AMMONIUM n’est pas toxique. Mais dans les eaux à pH supérieur à 7,5 une fraction peut être transformée en AMMONIAQUE (gaz AMMONIAC en suspension dans l’eau) toxique même à faible concentration pour les poissons et les organismes vivant dans l’eau. (L’élévation de la température du du pH amplifie le phénomène).
Nb : Heureusement dans les régions calcaires, le pH des eaux est rarement > 7,5.
Comme le montre le graphique ci-contre, la répartition ammonium/ammoniaque dans l’eau dépend du pH et de la température. (Il convient donc de mesurer ces deux paramètres quand on dose l’ammonium pour estimer les risques pour le poisson).
La présence d’ammoniaque dans l’eau à des concentrations même < 1 mg NH3/l entraine des mortalités piscicoles. Par exemple pour les truites, la CL50 96 (concentration Létale médiane sur 96 heures qui exprime la toxicité aiguë sur le poisson – mortalité de 50% des truites) n’est que de 0,4mg/l de NH3/litre d’eau ! Les alevins sont au moins 10 fois plus fragiles.
Et même présent à de très faibles doses non-toxiques, l’ammoniaque affecterait le métabolisme des poissons en diminuant leurs réflexes.
– Voir aussi page cycle de l’azote.. Analyse exprimée en mg/l. Des analyses de terrain de mesure de l’ammonium sont possibles à l’aide de trousses de réactifs. Attention en cas d’eau trouble perturbante, filtrer l’eau à analyser.
Les dosages colorimétriques sont perturbés par la présence de matières en suspension dans l’eau. Il est donc préférable de filtrer les échantillons d’eau avant les mesures,
NITRITES (NO_2)
(Azote nitreux; dangereux y compris pour les poissons).
Chez les mammifères, la consommation d’eau chargée de nitrites perturbe la fixation de l’oxygène pat l’hémoglobine du sang. (D’où la méthémoglobinémie ou la «maladie bleue du nourrisson »). Il ne doit donc pas avoir de nitrites dans l’eau du robinet et très peu de nitrates, car ils peuvent une fois bus se transformer en nitrites. Dans l’estomac, les nitrites, peuvent se transformer nitrosamines réputées cancérigènes. (A noter, que les nitrites sont ajoutés à la charcuterie (jambon, saucissons,…) pour la conservation… )
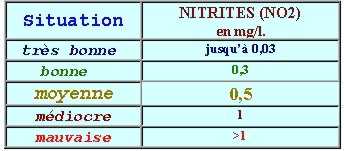
Dans l’eau les nitrites sont toxiques pour les poissons surtout lorsque le pH de l’eau est inférieur à 7.
Des concentrations même < 1 mg NO2/l entrainent des mortalités piscicoles. Elles posent problème au-dessus de 0,01mg/l. pour les truites.
L’effet de toxicité des nitrites est plus rapide que par celle de l’ammoniaque, (voir plus haut) car elle entraine la dégradation de l’hémoglobine des globules rouges et l’asphyxie des poissons.
Même en petite quantité les nitrites causent des stress chez les poissons, provoquant des problèmes respiratoires, affaiblissement, maladies, vulnérabilité… Les nitrites sont également toxiques pour les humains…
On comprend pourquoi la concentration en nitrites ne devrait pas dépasser 1 mg NO2/l dans les rejets de stations d’épuration. (0,5mg/l dans l’eau du robinet).
Des analyses de terrain des nitrites sont possibles avec des bandelettes test. Résultat d’analyse exprimé en mg/l.
– Voir aussi page cycle de l’azote. dont font partie les nitrites.
NITRATES (NO_3) (Azote nitrique)
Les nitrates des eaux souterraines et des cours d’eau proviennent:
– principalement d’origine agricole en raison du recours aux engrais azotés.
– en second lieu des rejets des stations d’épurations (transformation de la matière organique en nitrates). Certaines installations sont complétées par des traitements de dénitrification avant rejet.
– du milieu naturel, pour 3 et 7 mg/l. seulement, une quantité suffisante pour nourrir la vie aquatique des cours d’eau. (A delà c’est l’indigestion, le développement des algues, l’eutrophisation..)
Les nitrates posent problème en raison de leur trop grande introduction dans les eaux par l’agriculture industrielle (*). Les résultats d’analyse exprimés en mg/l de NO3-. Il faut diviser par 4,43 le poids des nitrates pour déterminer le poids d’AZOTE contenu par ces mêmes nitrates. (Ainsi la norme de 50mg/l de nitrates maximum dans l’eau du robinet correspond à une teneur en azote de 11,29 mg/l. Et 4,43 kg de nitrates contiennent 1 kg d’azote (N).)
(*) Dans l’eau les nitrates (NO3-) sont quantifiés en mg par litre (mg/l), alors que les apports d’azote dans les champs, sont exprimés en kg d’azote (N) par hectare (ou unité d’azote par hectare).
Bien que les nitrates soient énormément moins toxiques nocifs que les nitrites, il ne doit pas y en avoir plus de 50mg/l. dans l’eau du robinet. En effet une fois consommés, ils peuvent évoluer en nitrites dans l’estomac puis se transformer en nitrosamines toxiques et réputées cancérigènes.
Chez les poissons adultes, la toxicité des nitrates semble très faible. Il n’en est pas de même sur les œufs ou les larves dont la mortalité serait multipliée par deux selon les espèces. Des effets ont été signalés, même à des concentrations de 10-20mg/l.
– Analyses de terrain des nitrates possibles (bandelettes test). Voir page MO CYCLE DE L’AZOTE pour commentaire complet de ce paramètre.
AZOTE TOTAL KJELDAHL (abrév. NTK ou NK)
C’est la somme exprimée en mg/l. des composés non encore oxydés de l’azote : azote organique + ammoniacal contenu dans l’eau (donc sans les nitrites et les nitrates).
Résultat d’analyse exprimé en mg/l. Méthode normalisée en laboratoire.
Les épandages agricoles (lisier, engrais), les rejets des industries alimentaires, les rejets urbains peuvent être la cause d’une concentration élevée en azote Kjeldahl ce qui permet d’évaluer le niveau de pollution. Une personne rejette environ 15 g. par jour de NTK.
AZOTE GLOBAL (abrév. NGL)
C’est la somme en azote de toutes les formes d’azote différentes contenues dans un prélèvement (azote gazeux exclu):
NGL = azote totale Kjeldahl (azote organique et azote ammoniacal) + azote nitreux (nitrites / N-NO2) + azote nitrique (nitrates / N-NO3).
AZOTE TOTAL
C’est la mesure en azote de toutes les formes d’azote différentes: azote ammoniacal (NH4) + azote nitrique (NO3) + azote uréique (N uréique).
Azote total = azote ammoniacal + azote uréique + azote nitrique
.
LE PHOSPHORE
Le phosphore, élément indispensable au développement de tous les organismes vivants, ne doit être naturellement présent qu’en très faible quantité dans le sol et dans les eaux, au delà il constitue une pollution par perturbation de milieu aquatique.
Une présence importante de phosphates dans les eaux n’est pas naturelle. La plus grande part du phosphore que l’on retrouve actuellement dans les eaux des cours d’eau provient:
– des rejets d’eaux résiduaires, en premier lieu des déversements urbains, c’est à dire des déjections humaines, des matières organiques en décomposition, des polyphosphates des lessives … Le rejet en phosphore total (PT) d’une personne (= 1 équivalent habitant (EH) est d’environ 4 g. de PT par jour. En rapportant cette quantité au volume journalier des effluent de cette personne, on obtient une concentration d’environ 25 mg/litre de PT.
Il existe des techniques d’élimination du phosphore essentiellement par floculation dans certaines stations d’épuration équipées à cet effet. L’injection dans leurs effluents d’ions métalliques plurivalents (par exemple, calcium, aluminium, fer) entraine la floculation (précipitation) du phosphore dans les boues.
– des pratiques agricoles: épandages de lisiers et d’engrais phosphatés utilisés en agriculture (provenant des mines de phosphates du Maroc, des US, de Chine),et ruissellements d’effluents agricoles, écoulements de purins, déjections animales,..
De bonnes pratiques agricoles en matière d’élevage raisonnable, de gestion et d’épandage des effluents peuvent limiter les excès de phosphore.
Entrainé dans les eaux, cet élément s’y retrouve essentiellement sous forme de phosphore organique (résidu de la matière vivante) ou de phosphore minéral (ou phosphate inorganique) représenté essentiellement par les orthophosphates (PO4).
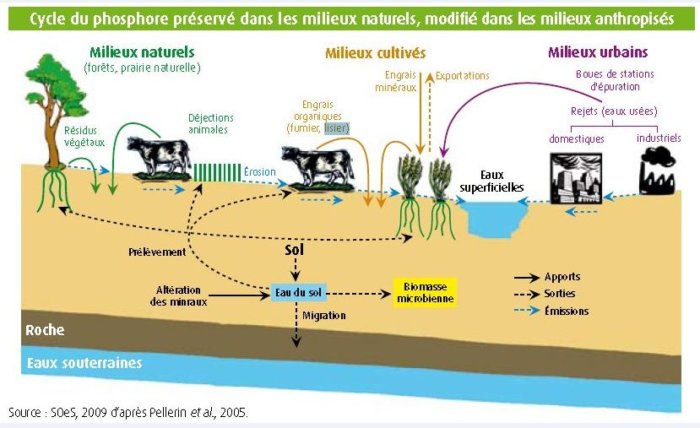
Dans l’eau, on en distingue la présence de phosphore sous 2 formes principales:
• Le phosphore particulaire appelé aussi résidus très fins d’origine biologique ou minérale.
• Le phosphore dissous, essentiellement constitués de phosphates (PO4), qui représentent 50 à 90% de la totalité du phosphore dans les eaux usées urbaines. De plus, ils constituent, au même titre que les nitrates, un agent fertilisant.
PHOSPHORE TOTAL (PT) (= P particulaire + P dissous). La réglementation, en ce qui concerne le phosphore, ne tient compte que de ce seul paramètre.
Il cumule l’ensemble du P. organique et du P. minéral. Il s’exprime en mg/l de PT. La quantité de PT d’une eau s’exprime en mg/l (milligrammes par litre).
PHOSPHATES (PO_4)
Les phosphates (appelés aussi orthophosphates) (ions PO4) sont la forme la plus simple et la plus répandue du phosphore dans l’eau.
La quantité d’orthophosphates d’une eau se mesure en mg/l. de PO 4
Dans les eaux superficielles, la teneur naturelle en phosphates est de l’ordre de 0,1 à 0,2mg de PO4/l. pour moins de 0,1mg de P/l. en phosphore total.
La mesure de la fraction organique de phosphore d’une eau s’obtient à l’analyse par différence entre le phosphore total et les orthophosphates.
Le phosphate de calcium minéral contenu dans les roches calcaires est peu soluble et n’est donc pas responsable de la pollution des eaux par excès de phosphore.
Critères analytiques du PO_4 dans l’eau :
- de 0 à 0,1mg/l. de PO_4 très bon.
- de >0,1 à 0,5 mg/l. : bon.
- de >0,5 à 1 mg/l. : médiocre.
- de >1 à 2 mg/l. : pollution.
- de >2 mg/l. : très pollué. (phosphore sédimentaire)
Dans les cours d’eau, les sédiments peuvent stocker ou relarguer du phosphore en fonction de l’état physico-chimique des eaux.
NITRATES et PHOSPHATES associés contribuent au développement excessif et anarchique des algues, voir page :L’EUTROPHISATION des rivières par les nitrates et les phosphates
‘
POTASSIUM (K)
Le potassium (K) Élément naturel indispensable à la croissance du vivant. Cependant sa présence en excès dans une eau (> 2 ou 3mg/l) est un indice de pollution par des effluents agricoles (lisier, ..) ou d’industries agro-alimentaires, qui en contiennent beaucoup. A moindre proportion, son origine peut être également l’utilisation d’engrais (et de lisier) dans le bassin versant amont. L’excès de K a peu d’impact sur la vie aquatique.
NPK
C’est ce qu’on appelle le trio azote, phosphate et potassium (NPK) dans l’utilisation des engrais agricoles nitrates, phosphates et potasses. Ces éléments nutritifs, tels que le phosphore, l’azote et le potassium, ne sont cependant pas entièrement utilisés par les végétaux cultivés, et une partie est emportée vers les ruisseaux et rivières par percolation et ruissellement.
.
SULFATES
Leur présence dans les eaux est en général liée à la présence de gypse dans les sols. C’est un composé naturel qui correspond à la présence de souffre dans l’eau. Présence maximum limitée à 250mg/l dans l’eau potable.
HYDROGÈNE SULFURÉ ou sulfure d’hydrogène,
Gaz nauséabond et toxique à forte odeur d’œuf pourri, produit par la fermentation anaérobie (sans air) quand l’eau est trop riche en matières organiques. C’est aussi un indice de présence d’organismes pathogènes.
ÉLÉMENTS CHIMIQUES POLLUANTS
LES MICROPOLLUANTS
Ce sont des composants minéraux ou organiques qui présents dans l’eau même à très faible quantité (en microgramme (µg/l), voire en nanogramme (ng/l) par litre) sont dangereux pour les êtres vivants et les écosystèmes.
Certains micropolluants sont toxiques. Les mécanismes de leur effets sont encore trop mal connus :
– Les éléments mutagènes agissent sur les cellules reproductives ou directement sur l’ADN des êtres vivants;
– Les éléments tératogènes qui affectent le fœtus;
– Les éléments cancérigènes qui induisent le cancer;
– Les éléments neurotoxiques qui agissent sur le système nerveux;
– Les éléments perturbateurs endocriniens;
– Les éléments bioaccumulables dans les chaînes alimentaires.
LES POLLUANTS INORGANIQUES
Ces sont des substances chimiques d’origine non organique qui peuvent être très toxiques pour les organismes vivants.
Ces substances peuvent se trouver dans l’eau (comme dans le sol et l’air) ce sont par exemple des métaux lourds ls proviennent surtout des émissions industrielles et déchets toxiques des gaz d’échappement des véhicules mais plus rarement d’origines naturelles de certaines roches et sols.
Le Chlore (Cl) est directement et extrêmement toxique dans l’eau pour la faune aquatique. Sa présence destructrice dans l’eau peut provenir de la vidange sauvage d’une piscine ou d’un déversement de Javel.
Le chlore est souvent utilisé comme désinfectant dans l’eau du robinet mais s’il y a présence d’autres composés organiques il peut produire des sous-produits potentiellement dangereux pour la santé, tels que les trihalométhanes.
Les MÉTAUX LOURDS (poids atomique > à celui du fer).
Ce qu’on désigne souvent sous le sigle ETM (Éléments Traces Métalliques) peuvent être naturellement présents dans l’environnement mais aussi rejetés par les activités humaines.
Les éléments métalliques et leurs dérivés organiques (métalloïdes) sont pour certains très dangereux parce que potentiellement toxiques, non-biodégradables et bioaccumulables dans les chaînes alimentaires.
Si, à doses infimes, certains métaux constituent des oligo-éléments indispensables à un bon état de la santé humaine, à partir de certaines doses plus importantes ils deviennent directement toxiques. Ces métaux proviennent un peu du sous-sol (érosion) mais pour l’essentiel des rejets industriels (traitements de surface, métallurgie, chimie, incinération de déchets, …) dans le sous-sol ou les rivières mais aussi dans l’atmosphère d’où ils retombent avec les pluies.
On retrouve les métaux dans les eaux sous formes ioniques libres ou incorporés dans des structures moléculaires ou des complexes organiques ou inorganiques… Ainsi pour le même métal, certaines formes peuvent être beaucoup plus toxiques que d’autres…
La concentration en METOX dans l’eau est la mesure de la quantité de métalloïdes dissous dans le liquide. La mesure de la concentration en métaux dans l’eau est parfois utilisée pour la surveillance de l’eau dans l’environnementale.
Critères analytiques pour chaque métal
– il existe des seuils à ne pas dépasser pour l’eau potable,
– des valeurs limites en métaux pour les épandages agricoles,
– des valeurs limites en métaux pour les rejets des Installations classées dans la nature ou dans un égout public.
Liste des principaux métaux lourds et métalloïdes en commençant par les plus toxiques:
– le mercure (Hg) Métal rare, extrêmement toxique et plus particulièrement néphrotoxique, c’est-à-dire agissant sur les reins, et neurologique, c’est-à-dire agissant sur le système nerveux. Les symptômes sont des troubles mentaux plus ou moins graves, une salivation excessive, des douleurs abdominales, des vomissements, de l’urémie (accumulation d’urée liée à une insuffisance de la fonction rénale). Ce métal dont l’utilisation est heureusement en déclin était extrait d’un minerai le cinabre.
Origines dans les eaux : Activités sanitaires (thermomètres, désinfectants, .amalgames dentaires..), Agriculture (fongicides, bactéricides), Industries (élimination des déchets, production de chlore et de soude, centrales au charbon), Orpaillage sauvage (en Guyane), Élimination des ordures ménagères piles, Lampes fluorescentes d’éclairage (à ne jamais mélanger aux ordures ménagères).
– le plomb (Pb). Ce métal est extrait d’un minerai, la galène. Le plomb est (était) utilisé dans l’industrie métallurgique: batteries, alliages, traitements de surface, munitions, (anciennes peintures), (ancien adjuvant antidétonant de l’essence) etc
C’est un métal très toxique pour les invertébrés et les amphibiens des milieux aquatique. Chez l’homme ses organes cibles sont le système nerveux central et périphérique, le système circulatoire, les reins et les organes de reproduction. Sa présence dans l’eau du robinet peut entrainer le saturnisme (par exemple par l’érosion des canalisations d’eau potable en plomb).
Enfin, l’ingestion de grenaille de plombs de chasse (confusion avec des grains de nourriture ou de sable) est particulièrement toxique pour les oiseaux et représente une cause fréquente de saturnisme aviaire.
– le cadmium (Cd), à l’origine est extrait de certains minerais notamment de zinc. Il est utilisé dans les batteries électriques mais surtout dans la métallurgie dans le cadmiage contre la corrosion de l’acier. Le cadmium est aussi utilisé en stabilisant pour les plastiques et les pigments. La pollution au cadmium provient des rejets industriels, des incinérations de déchets, de l’utilisation d’engrais… Extrêmement toxique (organe cible le rein, os, cancer du poumon) cet élément s’accumule dans les chaînes alimentaires et menace les prédateurs secondaires.
– l’arsenic (As). C’est un métalloïde. C’est un oligo-élément sous forme de trace. En concentration importante c’est un toxique (dose létale chez l’homme estimée à environ 0,6 mg/kg/j.) Il peut être naturellement présent dans les minéraux du sous-sol dans certaines régions (roches primaires, volcaniques). On peut trouver ainsi des contaminations naturelles à l’arsenic de certaines sources, dans le Massif Central, les Vosges, le Haut-Rhin… De l’arsenic peut être rejeté par les industries du verre ou de la métallurgie. Il peut provenir de sites d’exploitations d’anciennes mines (comme à Salsigne (11 ). L’ingestion d’arsenic peut entrainer des troubles physiologiques mais aussi des risques cancers.
– le chrome (Cr) : métal très dur utilisé en traitement de surface des métaux pour améliorer leur résistance. Ce n’est que dans les process industriels de traitements de surfaces qu’utilisé sous la forme de chrome hexavalent ou chrome VI et de chromates (CrO4) qu’il devient extrêmement toxiques pour la vie et cancérigènes. (risques de rejets dans les eaux).
– le cuivre (Cu) . Peu toxique, néanmoins à faible concentration il est nuisible pour la microfaune et les batraciens. Sa présence dans les eaux provient de l’érosion des conduites ou de l’activité industrielle. Dans les sols agricoles, il peut s’accumuler à la suite du traitement des cultures avec des sels de cuivre utilisés comme fongicide (bouillie bordelaise) et surtout des épandages répétés de lisiers de porcheries ou le cuivre il est utilisé comme facteur de croissance dans l’alimentation des porcs(voir cette page).. Chez certaine personne peut induire des problèmes de santé mais ne serait pas cancérogène.
A une concentration > 2 mg/l. il colore les eaux.
– l’aluminium (Al) est naturellement présent dans les sols. L’alumine (oxyde d’aluminium) qui sert à produire le métal aluminium est extraite principalement d’une roche sédimentaire, la bauxite. L’aspect et les propriétés physico-chimiques de ce métal ont favorisé d’innombrables utilisations.
L’aluminium a été longtemps considéré comme totalement neutre vis-à-vis de la santé et l’environnement. Il est d’ailleurs présent à d’infimes quantités dans le corps humain. Cependant au-delà, sa consommation dans l’eau, ou la nourriture, peut présenter une certaine toxicité et par exemple favoriser la maladie d’Alzheimer. Il est en effet de plus en plus présent dans les eaux où il peut provenir de l’industrie, des déchets ménagers, des sulfates d’alumines utilisé comme floculant dans les stations de traitement des eaux, etc.
Dans les eaux l’aluminium peut aussi provenir des sols qui en contiennent naturellement. En raison de la pollution, les pluies peuvent être acides et favoriser une certaine solubilité de l’aluminium qui est possible en dessous de pH 6. De l’aluminium peut alors se retrouver non seulement dans les eaux mais aussi dans les plantes et les animaux.
Dans l’eau potable, la directive du 3 novembre 1998 relative à la qualité des eaux destinées à la consommation humaine a fixé pour le paramètre « aluminium » une valeur de 200 microgrammes par litre dans les eaux de consommation. Ce paramètre est un indicateur de fonctionnement des installations de traitement et non pas un paramètre de santé faisant l’objet d’obligations plus strictes…
Selon M. Guy Berthon, ancien directeur de recherche au laboratoire de chimie du CNRS « l’aluminium ne sert à rien dans l’organisme humain. Pire à fortes doses ou à doses régulières il est toxique (…) en trouver dans l’eau du robinet, c’est criminel ». Le danger, selon ce chercheur, est que « si une partie est éliminée naturellement par les urines ou la barrière intestinale, une autre passe à travers ce mur de brique qu’est l’intestin grêle et se retrouve dans le sang puis le cerveau. Là l’aluminium se dépose, durcit et ne peut plus repartir ». Les symptômes principaux
sont des problèmes d’élocution, le développement d’une démence et de
convulsions. Observations d’encéphalopathies chez des patients en insuffisance rénale chronique, dialysés au long cours.
– le zinc, (Nn) : Métal utilisé pour recouvrir les métaux.
Il est peu toxique, puisque au niveau de traces c’est oligo-éléments utile à l’organisme. Le zinc est classé dangereux pour la faune aquatique.A noter qu’une présence importante de zinc dans les eaux indique souvent celles d’autres métaux ou polluants toxiques industriels.
Dans les sols agricoles, il peut s’accumuler à la suite des épandages de lisiers de porcheries (voir cette page).
– l’étain (Sn). Métal malléable. Réputé surtout toxique, pour les algues et le phytoplancton des cours d’eau.
– le nickel (Ni) A très faible quantité (>50 microgramme) est considéré comme un oligo-élément serait utile à la fonction pulmonaire dans l’organisme.
Au delà c’est une substance considérée comme cancérigène.
C’est aussi le plus allergisant des métaux.
– le manganèse (Mn). Dans les eaux, il provient du sous-sol ou il est mis en solution par le CO2 des eaux d’infiltration. Il peut aussi provenir de dépôts de déchets industriels. Sur les parois des rivières souterraines, des dépôts noirâtres de manganèse sont souvent visibles.
C’est un oligo-élément indispensable aux organismes vivants. Maximum à ne pas dépasser dans l’eau du robinet 0.05 mg/l. En concentration trop élevée il peut être toxique pour l’homme et donner à l’eau une couleur noirâtre qui peut lors de lessives tacher le linge. Des procédés permettent d’éliminer le manganèse au niveau des stations captages d’eaux potables.
– autres métaux éventuellement nocifs : Antimoine, Cobalt, Sélénium, Thallium, Vanadium,
Tous les métaux ne sont pas toxiques!
– le fer provient du sous-sol ou de l’industrie mais n’est pas nocif. Le sulfate de fer peut provenir des stations de traitement des eaux où il est utilisé comme floculant. C’est un oligoélément indispensable au bon fonctionnement des êtres vivants.
En excès dans l’eau il n’est pas nocif mais brunit l’eau ce qui peut entrainer des taches. Des précédés de déferrisation permettent d’éliminer les excès de fer dans l’eau si nécessaire avant distribution.
– le magnésium (Mg) provient du sous-sol où il est abondant. Il contribue avec le calcium à la dureté de l’eau. Il est bénéfique pour la santé (anti stress notamment).
Autres polluants inorganiques
–le fluorure,
– le cyanure (CN) C’est un Poison extrêmement toxique, utilisé dans les industries de traitement de surface des métaux. Dégradable au bout d’un certain temps dans les eaux mais où ils sont particulièrement mobiles.
LES POLLUANTS ORGANIQUES
Les polluants organiques sont des composés chimiques contenant du carbone et d’autres éléments tels que l’hydrogène, l’oxygène, l’azote, le soufre, le chlore, etc. Ces composés sont souvent toxiques pour les êtres vivants et ont des effets néfastes sur l’environnement.
Ils peuvent être produits naturellement (par exemple, des hormones ou des phéromones) ou par des activités humaines (chimie industrielle, pesticides, carburants, solvants, etc.). Ils peuvent être transportés dans l’air, l’eau et le sol, et ont une longue durée de vie, ce qui peut entraîner une accumulation dans l’environnement et une perturbation des écosystèmes.
LES PESTICIDES
Les herbicides et pesticides que l’on retrouve dans les eaux de surface ou souterraines sont à plus de 90% d’origine agricole. Avec la pluie et le ruissellement, ils se retrouvent dans les eaux souterraines ou dans les rivières. Ce sont des produits toxiques qui se dégradent plus ou moins bien dans l’environnement ou s’y transforment en métabolites possiblement encore plus toxiques que la substance mère.
– herbicides (atrazine, glyphosate,…)
– insecticide (DDT, …)
– fongicides
C’est aujourd’hui un nombre très important de molécules de synthèse dont pour la plupart les effets (surtout à long terme) sont mal ou inconnus.
12 pesticides souvent rencontrés dans les eaux souterraines : Aldrine, Dieldrine, Endrine, Isodrine, Alachlore, Atrazine, Atrazine DE, Atrazine DP, Diuron, Isoproturon, Simazine, Terbuthylazine
NB :Concernant les métabolites qui se forment dans la nature à partir de pesticides et peuvent en être parfois plus dangereux, une étude réalisée par des scientifiques suisses, est accessible en ligne sur le site calameo.com : Nouveaux produits pertinents de transformation des pesticides dans les eaux souterraines détectés à l’aide d’un dépistage ciblé et suspect des micropolluants agricoles et urbains.
Les PRODUITS ORGANIQUES PERSISTANTS (POP):
Ces composés, très dangereux pour l’environnement ( toxiques à faible concentration, parfois mutagènes, cancérigènes) sont des produits synthétiques heureusement assez peu solubles dans l’eau. On peut cependant les trouver en aval de sites industriels :
– Hydrocarbures Aromatiques Polycycliques (HAP). Dangereux pour les êtres vivants, de plus en plus rependus dans l’environnement ils proviennent surtout des activités humaines (incinération, combustion de carburants, etc..).
Les HAP sont solubles dans l’eau et se fixent fortement sur les matières particulaires et argiles. Le benzo[a]pyrène est le composé génotoxique le plus caractéristique de cette famille de molécules. Lentement biodégradables. Les H.A.P. sont suspectés d’être cancérigènes.
– Hydrocarbures chlorés. Ces composés organochlorés synthétiques sont difficilement biodégradables. Ce sont :
– Polychlorobiphényls (PCB) qui entrait dans la composition des fluides de refroidissement ou d’isolation, de peintures, de plastifiants. PCB est émis au cours de l’incinération des déchets et de certains combustibles.
– Solvants organiques : Trichloroéthylène (TRI), Trichloroéthane ou Chloroforme (TCE), Tetrachloroéthylène (PER), Hexachlorobenzène (HCB), Tétrachlorure de carbone, Dichloropropane, Dichloropropene (DPC), Dibromoethane, Dichloroethane, Bromobenzene, Chlorobenzene, Tetrachlorethane, Nitropropane, Dimethylformamide (DMF), Pyridine, …
– pesticides organochlorés (OCP),
-. Autres substances diverses : Tétrachlorure de carbone, hydrazine, dinitrophénol, alkylphénols (dans détergents, cosmétiques, produits de nettoyage et beaucoup de produits industriels).,…
Les PFAS (se dit Pi fasse)
PFAS est l’acronyme désignant de plus de 4700 substances perfluoroalkylées et polyfluoroalkylées dites polluants éternels.créées par l’industrie chimique et qui n’existaient pas dans la nature. Il s’agit de molécules extrêmement résistantes et stables en raison des liaisons indestructibles entre leurs atomes de fluor et de carbone qui les composent. (voir article sur les PFA)
PRODUITS MÉDICAMENTEUX ET VETERINAIRES
De grandes quantités de résidus d’antibiotiques, d’anti-inflammatoires, d’antidépresseurs, de contraceptifs, d’hormones œstrogéniques, etc. aboutissent dans les eaux résiduaires. La plupart de ces éléments ne sont pas arrêtés par les stations d’épuration.
Il existe en France plus de 3000 médicaments à usage humain et plus de 300 à usage vétérinaire. Une grande partie se retrouve dans les déjections et par la suite dans les sols, les eaux des milieux aquatiques….
Sans oublier les polluants radiologiques, tels que les isotopes radioactifs utilisés en médecine.
POLLUANTS DÉTRITIQUES
Il s’agit des déchets ou fragments de déchets provenant des activités humaines, industrielles et agricoles qu’entrainent les eaux.
La pollution par les microplastiques Voir : L’invasion plastique des eaux
PARAMÈTRES BACTÉRIOLOGIQUES
Les analyses microbiologiques réalisées en laboratoire ont pour but de déceler et évaluer la présence dans les eaux de microbes pathogènes dangereux pour l’homme : eau potable, eaux de baignade, … Les polluants microbiologiques sont les bactéries, les virus, les protozoaires, les parasites.
Ces analyses reposent sur la recherche dans les eaux de bactéries indicatrices de leur éventuelle contamination fécale, les Escherichia coli (E. coli) et les Entérocoques. Ces organismes, d’origine intestinale sont naturellement présents dans les déjections animales ou humaines qui via les déversements, eaux usées et épandages peuvent se retrouver dans l’eau. Les Entérocoques sont pathogènes de même que certains colibacilles. L’eau potable du robinet doit être exempte de la présence de ces bactéries.
Une présence très importante de germes fécaux dans une eau indique une pollution fécale importante d’origine humaine ou animale en amont d’un point d’eau.

